Uveïtis
Uveïtis is een verzamelnaam voor alle inwendige oogontstekingen. Bij de patiëntengroep Oogvereniging Uveïtis kun je terecht voor contact en informatie.
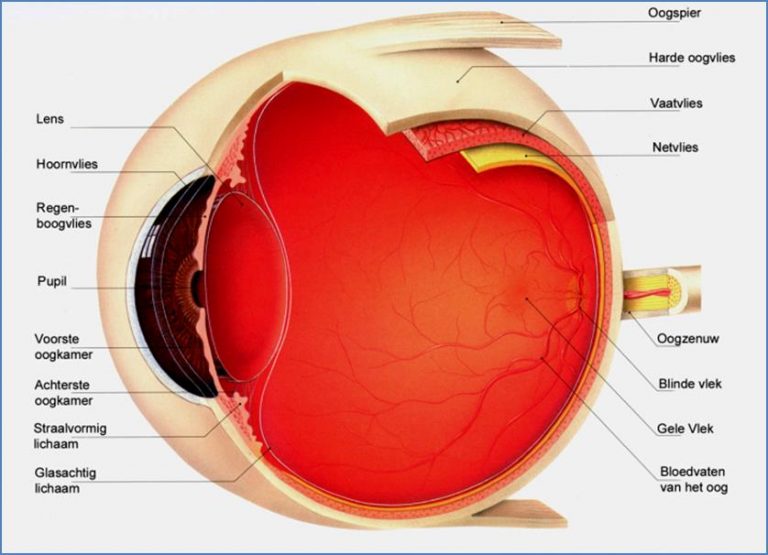
Wat is uveïtis?
Uveïtis is een verzamelnaam voor alle inwendige oogontstekingen
- Uveïtis komt niet vaak voor, ongeveer 1 op de 50.000 mensen krijgt een vorm van uveitis
- Uveïtis kan in één of beide ogen voorkomen
- De oorzaak van uveïtis is vaak onbekend, maar kan (in 40 tot 60% van de gevallen) een onderdeel zijn van een algemeen ziekteproces: de oogontsteking is dan een onderdeel van het ontstekingsproces in het lichaam
- Uveïtis kan zowel van infectieuze als niet-infectieuze oorsprong zijn
Verschillende vormen van uveïtis zijn:
- Uveïtis anterior (aan de voorkant; voorste oogkamer en iris)
- Uveïtis intermediair (middenin; glasvocht)
- Uveïtis posterior (aan de achterkant; netvlies)
- Panuveïtis (ontsteking van het hele oog)
Wat zijn de klachten bij uveïtis?
Uveïtispatiënten merken vaak een vermindering van het gezichtsvermogen van één of beide ogen. Ze zien wazig en hebben last van zwarte vlekjes of slierten in het beeld. Een aantal patiënten kan het licht niet goed verdragen.
Uveïtis kan heel plotseling beginnen met een pijnlijk, rood oog of met geleidelijk waziger zien. Het kan in één oog voorkomen of afwisselend in één van beide ogen, of in beide ogen tegelijkertijd. Kinderen kunnen uveïtis hebben zonder (merkbare) verschijnselen. Dat is bijvoorbeeld het geval bij jeugdreuma.
Wanneer je zicht vermindert, is het raadzaam contact op te nemen met je oogarts. Als het zicht plotseling ernstig vermindert dien je dezelfde dag contact op te nemen met de oogarts.
Hoe kun je uveïtis krijgen?
De precieze oorzaak van uveïtis is vaak onbekend. Wat we wél weten is dat het te maken heeft met een ontregeling van het afweersysteem. Het afweersysteem is een verdedigingssysteem van het lichaam, met als doel indringers of veranderde eigen cellen te bestrijden.
Uveïtis is niet besmettelijk en in principe niet erfelijk, maar komt soms wel bij meerdere familieleden voor. Uveïtis kan ook aangeboren zijn, bijvoorbeeld bij oculaire toxoplasmose. Toxoplasmose is een infectieziekte die wordt veroorzaakt door een parasiet. In de oog tast de parasiet het netvlies aan. Hier blijft hij zitten in kleine cysten, waardoor hij buiten bereik blijft van het immuunsysteem.
Uveïtis kan een geïsoleerde oogontsteking zijn, dat wil zeggen dat de ontsteking beperkt blijft tot het oog zelf.
Enkele oorzaken van een geïsoleerde oogontsteking kunnen zijn:
- Infecties zoals toxoplasmose, herpesinfecties en tuberculose
- Niet infectieuze uveïtis zoals Birdshot chorioretinopathie of sympatische ophthalmie
Uveïtis kan ook in verband gebracht worden met een andere lichamelijke aandoening (systemische ziekten).
Enkele voorbeelden:
- Reumagerelateerde aandoeningen
- Ziekte van Crohn
- Bindweefselziekten
- Sarcoïdose
Hoe wordt uitgezocht wat je hebt?
Met een standaard oogheelkundig onderzoek kan een oogarts vaststellen of er sprake is van uveïtis.
Bij dit onderzoek worden de pupillen met oogdruppels verwijd. Dit is het groter maken van de pupil met als doel het oog beter te kunnen onderzoeken. Daarnaast kunnen de druppels worden gebruikt als behandeling. Dit geeft een paar uur een waziger zicht. Soms is het niet mogelijk bij een eerste onderzoek vast te stellen of er sprake is van uveïtis. Daarvoor is verder aanvullend onderzoek nodig, zoals:
- Laboratoriumonderzoek (van bloed en soms van oogvocht)
- OCT-scan (Optical Coherence Tomography, scan van het netvlies). Optische Coherentie Tomografie is een speciale techniek om delen van het oog in beeld te brengen. De techniek werkt eigenlijk hetzelfde als echografie, alleen maakt een OCT-scan gebruik van licht in plaats van geluid.
- FAG (fluorescentie angiogram, foto’s van het netvlies met behulp van kleurstof). Dit is een onderzoeksmethode waarbij de oogarts eventuele afwijkingen van het netvlies opspoort met behulp van speciale kleurstoffoto’s. Een in water oplosbare kleurstof, fluoresceïne, wordt in een ader in de arm gespoten. De kleurstof verspreidt zich via de grote lichaamsader door het hele lichaam en wordt dus ook naar de vaten van het oog getransporteerd.
- Röntgenfoto of CT-scan van de longen
Waar kun je terecht bij uveïtis?
In principe kun je bij elke oogarts terecht met uveïtis. Afhankelijk van de ernst van de uveïtis en de expertise van je oogarts word je mogelijk doorverwezen naar een van de academische centra waar oogartsen werkzaam zijn die gespecialiseerd zijn in uveïtis. Deze centra zijn:
- UMC Groningen (UMCG)
- UMC Utrecht (UMCU)
- Amsterdam VUmc
- Amsterdam AMC
- Leids Universitair Medisch Centrum (LUMC)
- Maastricht UMC+
- Radboudumc Nijmegen
- Erasmus MC Rotterdam
- Het Oogziekenhuis Rotterdam
Als de uveïtis onder controle is word je vaak terugverwezen naar je eigen oogarts. Die neemt dan de controles weer over. Indien nodig vindt overleg plaats met het academische centrum of krijg je daar weer een afspraak.
Soms is het nodig om de uveïtis te behandelen met medicijnen waarvoor onder andere laboratoriumcontroles nodig zijn. Bij deze medicatie word je meestal begeleid door een immunoloog/reumatoloog of internist. Ook deze controles kunnen overgenomen worden door artsen in uw eigen ziekenhuis.
Hoe is de zorg bij uveïtis georganiseerd?
Wanneer de ontsteking zich beperkt tot het oog alleen, dan vinden de onderzoeken plaats op de polikliniek oogheelkunde. Je kunt dan te maken krijgen met:
- Oogarts
- TOA (technisch oogheelkundig assistent). Hij/zij doet de metingen voordat je bij de oogarts komt, maar is soms ook degene die de aanvullende onderzoeken verricht.
- Optometrist. Afhankelijk hoe de zorg in je ziekenhuis geregeld is, kan de optometrist de controle-onderzoeken doen. Soms zie je op die dagen geen oogarts.
- Oogheelkundig verpleegkundige. Afhankelijk hoe de zorg in je ziekenhuis geregeld is, geeft degene die het onderzoek verricht voorlichting en informatie over de planning van de onderzoeken.
- Wanneer er mogelijk sprake is van een systemische ziekte zal de oogarts je doorsturen naar:
- Internist
- Reumatoloog
- Longarts
Meer informatie kun je vinden op de website van Zorgkaartnederland.nl van Patiëntenfederatie Nederland.
Wat is de behandeling van uveïtis?
De behandeling van uveïtis is vooral gericht op onderdrukken (tot rust brengen) van de ontsteking en voorkomen van (vaak onherstelbare) schade. Er is geen medicijn om uveïtis te genezen.
- De keuze van de behandeling is afhankelijk van de soort uveïtis, van de ernst en het beloop
- De behandeling kan soms levenslang zijn
- Een aanval van uveïtis anterior duurt gemiddeld 6-12 weken
Uveitis anterior
- De behandeling van de meest voorkomende vorm van uveïtis (uveïtis anterior) bestaat uit ontstekingsremmende druppels (corticosteroïden).
- Verder worden vaak pupilverwijdende oogdruppels voorgeschreven. Deze voorkomen verkleving van de pupil met de lens en verlichten de eventuele pijn.
Intermediaire uveïtis, uveïtis posterior en panuveïtis en ernstige gevallen van uveïtis anterior
- In sommige milde gevallen kan worden afgewacht en hoeft er niet direct behandeld te worden
- Behandeling met ontstekingsremmende (corticosteroïd) druppels
- Corticosteroïden kunnen ook in het oog gespoten worden. Deze medicatie is enkele weken (celestone) of maanden (kenacort) werkzaam
- Er kan een corticosteroïd-implantaat in het oog worden ingebracht (Ozurdex)
- In ernstigere gevallen kan afweeronderdrukkende systemische medicatie gegeven worden, zoals corticosteroïden, methotrexaat, mycofenolaat mofetil (Cellcept of Myfortic), azathioprine (Imuran) of cyclosporine (Neoral). Dit is medicatie die werkzaam is in het gehele lichaam, dit in tegenstelling tot lokale medicatie, alleen werkzaam in bijvoorbeeld het oog. Soms worden biologicals (nieuwe, sterke afweer onderdrukkende medicijnen) voorgeschreven
- In sommige gevallen is een operatie nodig om de oorzaak te achterhalen. Dit gebeurt door middel van een vitrectomie, ook wel glasoperatie genoemd, of om de complicaties van uveïtis te behandelen
- De behandeling met oogdruppels en injecties bij het oog gebeurt door de oogarts. Bij behandeling met afweeronderdrukkende medicatie wordt een internist, immunoloog of reumatoloog in medebehandeling gevraagd. Hierbij wordt het bloed elke 3 maanden gecontroleerd op bijwerkingen
- Het is belangrijk dat een infectie als oorzaak van uveïtis wordt uitgesloten
Helaas zijn er soms bijwerkingen bij langer medicijngebruik:
- Staar of cataract (bij gebruik corticosteroïden)
- Glaucoom (bij gebruik corticosteroïden)
- Algeheel malaisegevoel (bij gebruik systemische medicatie). Ook is het mogelijk dat je last krijgt van gewichtstoename, haaruitval en depressieve gevoelens
Keuzekaart
Heb je last van niet-infectieuze uveïtis? En werken oogdruppels niet voldoende of zijn oogdruppels niet geschikt voor jou? De Keuzekaart Niet-infectieuze uveïtis kan helpen als jij en je arts de keuze tussen prednison slikken of een injectie bij of implantaat in het oog bespreken.
Welke risico’s of bijwerkingen zijn er?
Bij uveïtis kun je te maken krijgen met andere oogproblemen en met een algeheel malaisegevoel. Dit zijn deels gevolgen van de aandoening zelf en deels kunnen ze optreden als bijwerkingen van medicijnen.
Malaisegevoel
Hiervan kun je last krijgen als je systemische medicatie gebruikt. Bij een algeheel malaisegevoel kun je denken aan:
- lichte verhoging of koorts
- vermoeidheid
- zich futloos voelen
- weinig of geen eetlust hebben
- misselijkheid
- last van de maag/buik
- gewichtstoename
- haaruitval
- depressieve gevoelens
Glaucoom
Bij glaucoom wordt de oogzenuw beschadigd. Dit geeft heel langzaam uitval in het gezichtsveld. Vaak is bij glaucoom de oogdruk te hoog, maar de oogdruk kan ook normaal zijn.
Staar
Staar is een vertroebeling van de ooglens. Dit zorgt ervoor dat je wazig gaat zien.
Macula-oedeem
Macula-oedeem is vochtophoping in de gele vlek of macula. Deze vochtophoping ontstaat doordat bloedvaatjes vocht lekken. De gele vlek is belangrijk voor het optimale scherpe zien. Bij macula-oedeem daalt het gezichtsvermogen. Soms heb je last van beeldvertekening: rechte lijnen van bijvoorbeeld tegels of deurposten zien er krom uit.
Bandkeratopathie
Bandkeratopathie is een vertroebeling van het hoornvlies. De troebelingen hebben een wit/grijze kleur en beginnen vaak aan de randen van het hoornvlies en in het horizontale vlak. Aanvankelijk begint de bandkeratopathie met fijne stofachtige neerslagen. In de loop van de tijd breiden troebelingen zich uit waardoor een witte horizontale band in het midden van het hoornvlies ontstaat.
Hoe is het verloop bij uveïtis?
Alle vormen van uveïtis kunnen leiden tot een tijdelijke of blijvende vermindering van het gezichtsvermogen. Uveïtis kan zeer wisselend verlopen: het kan eenmalig optreden zonder blijvende gevolgen, maar het kan ook chronisch aanwezig zijn met afwisselend rustige perioden en perioden waarin het ontstekingsproces toeneemt.
De ontsteking kan verschillende delen van het oog beschadigen. Oogproblemen als gevolg van de ontsteking of medicatie zijn: vocht in het netvlies (macula oedeem), netvliesschade, staar (cataract), glaucoom als gevolg van verhoogde oogboldruk en hoornvliesafwijkingen.
Wat kun je zelf doen bij uveïtis?
Het is heel belangrijk dat je je houdt aan het met de arts afgesproken behandelplan. Bespreek veranderingen in je zicht of lichamelijke gesteldheid altijd met je behandelaar. Neem bij twijfel contact op met je behandelaar.
Plotseling stoppen of op eigen initiatief iets in het medicatie- of behandelplan veranderen kan toename van de ontsteking tot gevolg hebben. Acuut stoppen met bijvoorbeeld Prednison kan een negatief effect hebben op de werking van de bijnieren. Prednison moet langzaam worden afgebouwd in overleg met de arts.
Wat zijn de gevolgen voor het dagelijks leven?
Na de diagnose wordt het behandelplan met je besproken. De uveïtis kan tijdelijk van aard zijn of chronisch. Je krijgt te maken met regelmatige oog- en bloedonderzoeken.
Het is noodzakelijk dat je de voorgeschreven medicatie gebruikt om de ontstekingen terug te dringen. Deze medicatie heeft positieve invloed op je ogen, maar kan bijwerkingen hebben op de rest van het lichaam en het algemeen welbevinden.
Door de uveïtis kan het moeilijk zijn om je (dagelijkse) werkzaamheden te verrichten vanwege het verminderde zicht en de medicatie die een negatieve invloed kan hebben op de rest van je lichaam en op het algemeen welbevinden. Iemand die last heeft van uveïtis kan zich onzeker voelen over de toekomst: wat zijn de gevolgen voor het zien, ’word ik blind?’
In het dagelijks leven zul je niet gauw iemand tegenkomen die ook uveïtis heeft. Dit kan leiden tot onbegrip: het kan lastig zijn om je situatie duidelijk te maken. Een gesprek met lotgenoten kan een positieve bijdrage leveren aan de verwerking en de acceptatie van het hebben van uveïtis.
Er zijn organisaties die je kunnen helpen bij het verbeteren van de werkplek, de leesbaarheid van het computerscherm, de verlichting in je woning etc. Voor meer informatie over deze zaken kun je terecht op het onderdeel Leven met een oogaandoening of op de websites van Bartimeus of van Koninklijke Visio.
Voor vrijwel elk oogonderzoek krijg je pupilverwijdende oogdruppels in de ogen toegediend. Hierdoor zie je waziger en heb je meer last van (fel) licht. Zorg dat je in die situaties een petje en/of zonnebril bij je hebt. Zelf autorijden na een (oogheelkundig) onderzoek wordt afgeraden. Veel mensen vinden het prettig om een begeleider mee te nemen naar het ziekenhuis. Informeer bij de oogarts of uw uveïtismedicatie invloed heeft op vruchtbaarheid en zwangerschap. Wil je hierover meer weten, bespreek dit dan met uw behandelaars of raadpleeg de genoemde websites.
Bekijk de video
Download de folder
Sluit je aan bij Oogvereniging Uveïtis en blijf op de hoogte
Oogvereniging UveïtisZit je met een vraag?
De medewerkers van de Ooglijn staan elke werkdag van 09:00 tot 15:30 voor je klaar.
030 29 45 444Of stel je vraag via